Evaluatie van de veiligheid van etranacogene dezaparvovec in deze studies
Zoals elk geneesmiddel kan ook dit geneesmiddel bijwerkingen hebben, al krijgt niet iedereen daarmee te maken. De bijwerkingen werden waargenomen in de klinische studies met etranacogene dezaparvovec:
Zeer vaak (komen voor bij meer dan 1 op de 10 patiënten)
- hoofdpijn
- verhoging van het leverenzyme alanine-aminotransferase (ALT) in het bloed
- verhoging van het leverenzyme aspartaat-aminotransferase (AST) in het bloed
- griepachtige ziekte
- stijging van de concentratie van C-reactief proteïne (CRP), een ontstekingsmarker, in het bloed
- reactie op het infuus: allergische reacties (overgevoeligheid), reactie op de plaats van het infuus, duizeligheid, jeukende ogen (pruritus), rood worden van de huid (blozen), pijn in de bovenbuik, jeukende huiduitslag (urticaria), ongemak in de borstkas en koorts)
Vaak (komen voor bij minder dan 1 op de 10 patiënten)
- duizeligheid
- misselijkheid
- vermoeidheid
- zich algmeen onwel voelen (malaise)
- verhoogde bloedspiegels van bilirubine, een geel afbraakproduct van de rode bloedcellen
- verhoogde bloedspiegels van creatinekinase, een enzym (eiwit) dat vooral in het hart, de hersenen en de skeletspieren zit
Van de 54 patiënten heeft 1 een gedeeltelijke dosis (10% van de aanbevolen dosis) gekregen als gevolg van een reactie op het infuus tijdens de toediening, en één patiënt die 75 jaar was bij het begin van de studie is 15 maanden na de toediening van etranacogene dezaparvovec overleden aan een cardiogene shock, waarvan bevestigd werd dat die geen verband hield met de gentherapie.
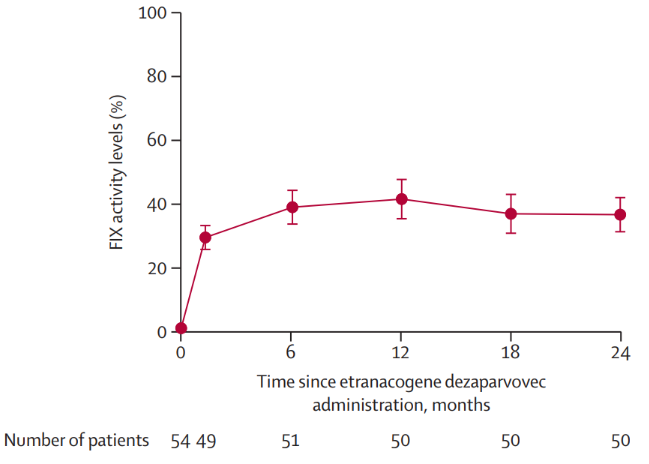
Werkzaamheid van etranacogene dezaparvovec in deze studies
De fase 3-studie bij 54 patiënten:
Wat de onderzoekers wilden onderzoeken in deze studie was een vermindering van het totaal aantal bloedingen per jaar (de ‘ABR’ (annual bleeding rate)) ten opzichte van de periode vóór de behandeling met deze gentherapie. Tussen maand 7 na de toediening en 2 jaar na de toediening daalde het gemiddeld aantal bloedingen per jaar van 4.19 naar 1.51, een daling van 64%. Het gemiddeld aantal gewrichtsbloedingen daalde van 2.14 naar 0.32 en ook het aantal spontane bloedingen daalde significant.
21 Pipe SW, Leebeek FWG, Recht M, Key NS, Castaman G, Miesbach W, et al. Gene Therapy with Etranacogene Dezaparvovec for Hemophilia B. New Engl J Med. 2023;388(8):706–18.
31 Drygalski A von, Steven P. Stable and durable factor IX levels in hemophilia B patients over 3 years post etranacogene dezaparvovec gene therapy. Blood Advances. 2022
41 Coppens M et al. Lancet Haematol 2024 ; 11 (4) : e265-e275 Etranacogene dezaparvovec gene therapy for haemophilia B (HOPE-B) : 24-month post-hoc efficacy and safety data from a single-arm, multicentre, phase 3 trial
